
Die Christmas-Krankheit und der Christmas-Faktor

Kurz vor Weihnachten erreicht das geschäftige Treiben seinen Höhepunkt: In den Läden herrscht reges Gewimmel, während eilig die letzten Geschenke ausgesucht werden. Genau wie ausdauernde Alpinisten im Sommer laufen nun auch die festlichen Vorbereitungen auf Hochtouren. Das Geschäft brummt.
Auf den Straßen brummt es ebenso; und zwar weil die Menschen in Hülle und Fülle unterwegs sind, um alles rechtzeitig zu erledigen, bevor die Familie sich für den alljährlichen Besuch versammelt.
Passen Sie auf leichtsinnige Fußgänger auf, wenn Sie mit Ihrem Auto unterwegs sind! Vor allem während dieser dunklen Jahreszeit kann es immer wieder vorkommen, dass eifrige oder gestresste oder glühweinselige Last-Minute-Shopper nicht nach links, dann rechts, dann links schauen, bevor sie die Straße überqueren. Im schwarzen Mantel und mit schwarzer Mütze sind diese Schemen sowieso schon kaum erkennbar, und durch unachtsames Verhalten von deren Seite und auch Ihrer Seite kann da ganz schnell ganz Schauriges passieren.
Fußgänger sollten Fahrbahnen und Radwege meiden und auf dem Gehweg bleiben. Um Straßen möglichst sicher zu überqueren, stehen meist Übergänge wie Ampeln oder Zebrastreifen zur Verfügung.
Apropos Zebrastreifen: Den gibt es übrigens noch gar nicht so lange. Erst 1952 wurden in München das erste Mal Zebrastreifen auf der Fahrbahn markiert, und erst ein Jahr später führte der Gesetzgeber den schwarz-weißen Fußgängerüberweg bundesweit (in Westdeutschland) ein. Interessanterweise dauerte es knapp 12 Jahre, bis einheitlich beschlossen wurde, dass der Fußgänger auf dem Zebrastreifen den Vorrang vor dem allgemeinen Fahrzeugverkehr genießt (sog. Lex Zebra).
Neben diesem fundamentalen „Eingriff“ in die Straßenverkehrsordnung wurde das Jahr 1952 auch von anderen Ereignissen geprägt: Zu Beginn des Jahres 1952 fanden die Olympischen Winterspiele statt – zum ersten Mal nach dem Zweiten Weltkrieg durften hier wieder deutsche Sportler teilnehmen. Im Juni desselben Jahres wurde die Urausgabe von Deutschlands liebstem Boulevardblatt, der BILD, gedruckt. Im September wurde die erste künstliche Herzklappe in die Aorta descendens einer US-amerikanischen Patientin mit Aortenklappeninsuffizienz transplantiert. Und gegen Ende des Jahres durften die Leute in der DDR zum ersten Mal für zwei Stunden pro Tag fernsehen.
Und während die einen fernsahen, lasen die anderen. Vielleicht ja in der Weihnachtsausgabe des British Medical Journal vom 27. Dezember 1952 über die Christmas-Disease. Ob sich diese Wissenschaftsinteressierten damals schon ausmalen konnten, welchen bedeutenden Beitrag zur Weiterentwicklung der Forschung im Rahmen humaner Gerinnungskaskaden durch diese Krankheitsentdeckung geleistet wurde?
Aktuelle Zahlen des Statistischen Bundesamtes (von 2023) zeigen, dass mehr als die Hälfte aller tödlich verunglückten und ein Drittel der schwerverletzten Fußgänger 65 Jahre oder älter ist. © 1
Doch beginnen wir erst einmal mit dem Ereignis, welches den Schneeball überhaupt ins Rollen brachte:
„Ho-ho-hoffentlich geht es ihm bald besser?“, wird die Mutter des kranken Jungen wahrscheinlich mit zittriger Stimme gefragt haben, als sie ihn 1952 in ein Londoner Krankenhaus brachte. Ihr Junge hieß Stephen Christmas und war 5 Jahre alt.
Schon seit einem Alter von 20 Monaten hatte er zahlreiche starke Blutungsepisoden, meist infolge von Verletzungen während des Spielens. Jedes Mal erhielt er Bluttransfusionen, die jeweils zu einem Stillstand der Blutungen führten. Eine familiäre Vorgeschichte von Blutungen gab es nicht.
Aufgrund dieser „Blutungsneigungen“ könnte man heute auf die Diagnose der Hämophilie stoßen. Hämophilie ist eine X-chromosomal rezessiv vererbte Krankheit, die hauptsächlich bei männlichen Personen auftritt und zu einer verzögerten oder gar nicht stattfindenden Blutgerinnung (Hämostase) führt.
Zur Hämostase
Hämostase meint die Gesamtheit aller physiologischen Prozesse, welche den Stillstand einer Blutung herbeiführen. Die Hämostase ist somit eine lebenswichtige Funktion, die den Körper vor Verbluten schützt und die Wundheilung unterstützt. Damit sie reibungslos ablaufen kann, müssen genügend Gerinnungsfaktoren vorhanden sein.
Bei der Ruptur des Endothels eines Blutgefäßes aktivieren sich Thrombozyten, die sich an die entstandenen Lücken im Endothel anheften (bzw. an die freigelegten subendothelialen Kollagenfasern) und sich miteinander verzahnen (d.h. sie aggregieren). Die Anheftung wird durch den von-Willebrand-Faktor (vWF) vermittelt. Die Thrombozyten entleeren Granula, die die Vasokonstriktion des entsprechenden Blutgefäßes bewirken, die Hämostase anstoßen sowie die Wundheilung fördern. Während sich dadurch die Blutzirkulation im lädierten Abschnitt verringert, bilden die Thrombozyten Serotonin, Thromboxan A2 und den Plättchenfaktor 3 (PF3). Serotonin und Thromboxan A2 fördern die Vasokonstriktion und Aggregation. PF3 startet die plasmatische Gerinnung.
Anschließend verbinden sich Fibrinpolymere mit den Thrombozyten und bilden Fibrinogenbrücken, durch die ein Thrombozyten-Pfropf entsteht, der den verletzten Gefäßabschnitt provisorisch verschließt.
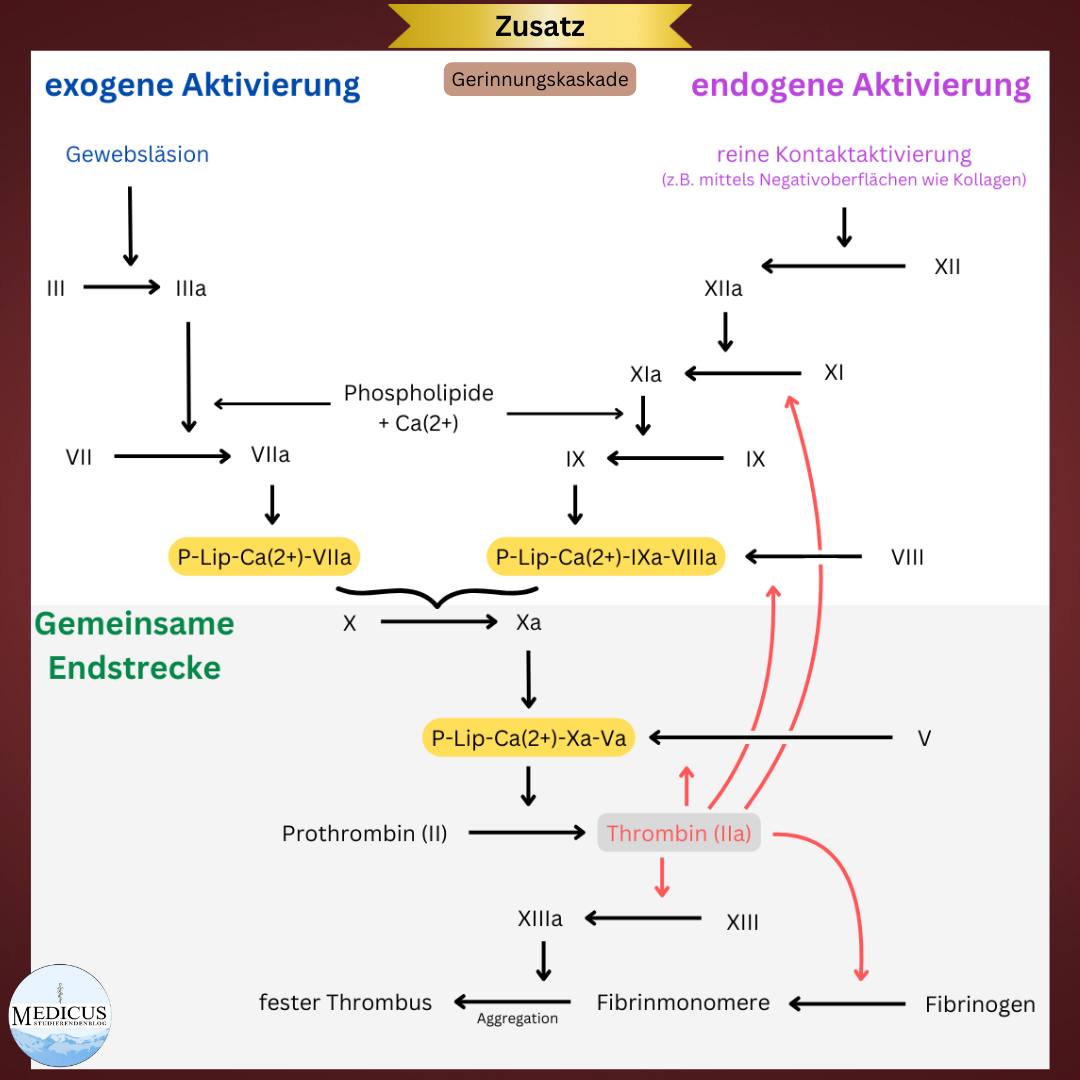
Die Gerinnungskaskade © 2
Diesem Vorgang der primären Hämostase schließt sich die sekundäre Hämostase an:
Der dauerhafte Verschluss des verletzten Endothels geschieht durch ein engmaschiges Fasernetz aus Fibrin und Thrombozyten, den Thrombus. Dieses Endprodukt der sekundären Hämostase wird auch als Blutgerinnsel bezeichnet, denn hier findet die eigentliche plasmatische Blutgerinnung statt. Die Blutgerinnung kann man sich wie eine Kette von Ereignissen vorstellen, bei der jedes Ereignis das nächste aktiviert – quasi dominoartig. Diese Gerinnungskaskade ist jedoch kein unkontrolliert anwachsendes Schneeballsystem, sondern sehr präzise reguliert dank verschiedener Gerinnungsfaktoren. Diese befinden sich als proteolytische Enzyme inaktiv im Plasma und müssen erst durch andere Faktoren aktiviert werden. Insgesamt gibt es 13 Gerinnungsfaktoren (I bis XIII), die in der aktivierten Form ein „a“ als Zusatz bekommen (z.B. IXa).
Es existieren zwei Formen der Gerinnungskaskade.
Das extrinsische System wird hauptsächlich bei exogener Endothelschädigung aktiviert, also bei Gewebsläsionen von außen. Phospholipoproteine aus den Membranen der verletzten Blutgefäße, die Thromboplastine (Faktor III), werden ins Blut freigesetzt und aktivieren die Gerinnungskaskade, indem sie die Umwandlung von Faktor VII zu Faktor VIIa starten. Faktor VIIa aktiviert wiederum zusammen mit Kalziumionen (Ca2+ bzw. Faktor IV) und Phospholipiden den Faktor X zu Faktor Xa.
Das intrinsische System dominiert bei reinen Endotheldefekten ohne äußere Schädigungsquelle. Es sorgt dafür, dass bestimmte Reaktionen direkt an der Außenseite der aktivierten Thrombozyten ablaufen und ist ebenfalls für die Fibrinvermehrung verantwortlich. Durch den Kontakt mit freigelegten Kollagenfasern wird Faktor XII aktiviert, der die Gerinnungskaskade in Gang setzt. In weiterer Folge aktivieren sich die Faktoren XI, IX und VIII, unterstützt vom vWF. Die Faktoren VIIIa, IXa, Ca2+ und Phospholipide aktivieren wiederum den Faktor X. An diesem Punkt vereinen sich das intrinsische und das extrinsische System zu einer gemeinsamen Endstrecke.
Durch einen Komplex aus Phospholipiden, Ca2+, Faktor Xa und Faktor Va (sog. Prothrombin-Aktivator-Komplex) wird das Prothrombin (Faktor II) im Plasma zu Thrombin (IIa) gespalten. Thrombin verstärkt die Aktivierung der Faktoren V, VIII und XI durch positive Rückkopplung, wandelt Fibrinogen in Fibrin um und aktiviert den Faktor XIII. Im weiteren Verlauf bildet sich aus Fibrin und aggregierten Thrombozyten der Thrombus (s. Abbildung 2 zur Veranschaulichung der Gerinnungskaskade).
Was fehlt Stephen nur? © 3
Zur Hämophilie
Bei Hämophilie ist das intrinsische System der Gerinnungskaskade aufgrund eines Mangels an bestimmten Gerinnungsfaktoren beeinträchtigt. Laboruntersuchungen zeigen eine verlängerte Gerinnungszeit für Vollblut und eine unzureichende Umwandlung von Prothrombin in Thrombin während der Gerinnung.
Dadurch kommt es insgesamt zu starken Blutungen, selbst aus kleinen Wunden, die auch ohne erkennbare Gewebeschäden spontan auftreten können. Weitere typische Symptome sind großflächige Blutergüsse (Hämatome) und Einblutungen in Gelenken.
Diese Symptome zeigte auch Stephen Christmas, allerdings ohne positive familiäre Vorgeschichte für Hämophilie, weswegen man bei ihm die gängigen Tests zwecks definitiver Hämophilie-Diagnostik durchführte. 1952 bestand diese hauptsächlich aus dem Test nach Merskey (von 1950).
Dieser Test beruht auf der Tatsache, dass normales Blut, das in kleinen Mengen zu hämophilem Blut hin-zugefügt wird, die Gerinnungszeit des hämophilen Blutes verkürzt, während die Zugabe von hämophilem Blut in hämophiles Blut keine Wirkung hat. Normales Blut enthält das anti-hämophile Globulin (AHG bzw. Faktor VIII), das bei Hämophilie fehlt.
Christmas‘ Blut wurde mit dem Blut eines bekannten hämophilen Patienten gemischt. Die Gerinnungszeit wurde gemessen und mit der Gerinnungszeit einer Kontrollprobe verglichen, in der Christmas‘ Blut mit normalem Blut vermischt wurde. Da das normale Blut das AHG enthält, würde dessen Zugabe die Gerinnungszeit von Christmas‘ Blut verkürzen, wodurch seine Hämophilie-Krankheit bestätigt wäre.
Das Ergebnis war jedoch unerwartet: Zwar verkürzte das Mischen von Normalblut mit Christmas‘ Blut die Gerinnungszeit. Allerdings führte auch das Mischen von Christmas‘ Blut mit dem hämophilen Blut eines anderen Patienten zu einer verkürzten Gerinnungszeit!
Wahrscheinlich ist es nicht notwendig zu sagen, dass die Durchführung des Merskey-Tests an Christmas (durch Biggs et al. um 1952) zu großer Verwunderung führte. Auch in weiterer Folge entdeckte man, dass die Mischung aus Blutproben zweier Patienten, die beide anscheinend an der klassischen Hämophilie litten, in manchen Fällen zu einer verkürzten Gerinnungszeit führte, als wenn die Proben separat untersucht wurden.
Die Mediziner betrachteten dieses Wunder mit staunenden Augen. Wie war das möglich? War das diese sagenumwobene Weihnachtsmagie, die in Stephen Christmas ihren Ausdruck fand, indem sie sein hämophiles Blut doch nicht hämophil machte, aber irgendwie dann schon?
Neben Christmas’ mythischer Blutungsneigung nahmen Biggs et al. noch weitere sechs männliche Patienten zwischen 7 und 28 Jahren als Probanden, die aufgrund langjähriger, exzessiver Hämorrhagien auffällig geworden waren. Zum Beispiel wurde ein 21jähriger Patient in der Klinik vorstellig, und zwar aufgrund “prolonged bleeding after four separate tooth extractions, one of which required a transfusion of […] 2.3 liters of blood”. Mit 16 Jahren litt er drei Wochen lang an Hämaturie (vermehrte Erythrozyten im Urin, wahrscheinlich durch eine Verletzung im Harnsystem, z.B. in einer der Nieren oder der Blase). Mit 17 Jahren hatte er ein Hämatom an der Pobacke, das vier Wochen brauchte, um abzuheilen. Auch sein jüngerer Bruder (3,5 Jahre) blutete drei Wochen lang, als er sich eine schnittartige Verletzung an der Lippe zuzog. Und der Großvater des Patienten starb sogar an starker Hämorrhagie.
Der 21jährige zeigte demnach alle Anzeichen von Hämophilie, plus positiver Familienanamnese! Und trotzdem: Mixte man sein Blut mit dem Blut eines bekannten hämophilen Patienten, verringerte sich dennoch die Gerinnungszeit!
Blutuntersuchungen von 1952 zeigten, dass bei allen 7 Fällen der Gerinnungsfaktor AHG in normalen Mengen vorhanden war, aber die Bildung von Thromboplastin war aufgrund eines Mangels eines weiteren, bisher unbekannten Gerinnungsfaktors stark vermindert. Dieser wurde daraufhin zum Christmas-Faktor getauft.
Weitere Informationen zur Hämphilie: (4) Zusammenfassung der Gerinnungsfaktoren sowie (5) Hämophilie-Formen und Schweregrade © 4 + 5
Wie Christmas der Hämostaseologie Erleuchtung schenkte
All dies veranlasste Biggs et al. damals zur Annahme, dass es eine Hämophilie-ähnliche Krankheit geben musste, die alle Symptome einer „normalen“ Hämophilie aufwies, aber dennoch keine klassische Hämophilie war.
Die Christmas-Krankheit war geboren, und aus der Krippe entstieg die festliche Offenbarung, dass es zwei hämophile Formen gibt: Die klassische Hämophile und „a condition previously mistaken for haemophilia: Christmas disease“.
Heutzutage sind diese beiden Formen als Hämophilie A und Hämophile B bekannt. Bei Hämophilie A kommt es zu einem Mangel an Faktor VIII (AHG A), bei der Hämophilie B zu einem Mangel an Faktor IX (AHG B). Hämophilie B tritt wesentlich seltener auf; ein Umstand, der dazu führte, dass man diese Hämophilie-Form erst 1952 entdeckte. Die verkürzte Gerinnungszeit bei der Mischung der Blutproben eines klassischen Hämophilie-Patienten (Hämophilie A) und von einem der sieben Probanden (Hämophilie B) lässt sich durch das Fehlen der unterschiedlichen Faktoren erklären: Die Mischung beider Blutproben führte dazu, dass der jeweils fehlende Faktor (VIII bzw. IX) im Blut des anderen Patienten wieder vorhanden war. Dadurch konnte die Gerinnungskaskade teilweise wieder funktionieren, was die Gerinnungszeit verkürzte.
Das war den Forschern um 1952 jedoch nicht bekannt, weswegen Hämophilie B anfangs nicht als eine Form der Hämophilie erkannt wurde, sondern als eigenständige Christmas-Krankheit bezeichnet wurde.
Des Weiteren war auch der Merskey-Test zu ungenau. Heute aber können alle bekannten Hämophilie-Formen eindeutig durch die Messung der jeweiligen Faktoren im Blut diagnostiziert werden. Weitere Formen von Hämophilie sind u.a. die Hämophilie C (Mangel an Faktor XI) oder Parahämophilie (Mangel an Faktor V).
Zwar wurde die Christmas-Krankheit nach 1952 in Hämophilie B umbenannt, doch ein gebräuchliches Synonym des damit verknüpften Gerinnungsfaktors AHG B lautet heute noch Christmas-Faktor.
Hämophilie B – oder auch: blutrote Weihnachten? © 6
Frohes Fest und schöne Pferde!
Die Christmas-Krankheit hat also nichts mit Weihnachten zu tun. Sie wurde nicht nach Father Christmas, sondern nach Stephen Christmas benannt. Auch die Tatsache, dass die erstmalige Beschreibung der Krankheit ausgerechnet in der Weihnachtsausgabe des British Medical Journal vom 27. Dezember erschien, war wahrscheinlich zufällig und ebenfalls nicht ausschlaggebend für die Benennung.
Apropos, da wir ja zu Beginn vom Zebrastreifen sprachen: Ebenfalls nicht ausschlaggebend für dessen Benennung waren die afrikanischen Unpaarhufer mit dem schwarz-weißen Streifenmuster.
Die Fahrbahnmarkierung für Fußgänger etablierte sich zwar 1953 bundesweit in Westdeutschland, trotzdem hielt das die Autofahrer nicht davon ab, wie aufgescheuchte Rentierhorden gleichgültig da drüber zu brettern. Deswegen startete die Hamburger Polizei 1954 in Kooperation mit einer Zeitung die Aktion „Zebra„, damit Autofahrer auch wirklich für die Fußgänger anhielten. „Zebra“ ist dabei eine Abkürzung für „Zeichen eines besonders rücksichtsvollen Autofahrers“. Die Aktion war von Erfolg geprägt und die Autofahrer hielten freiwillig für die Fußgänger an. (Zur Erinnerung: Lex Zebra wird erst am 1. Juni 1964 in Kraft treten!)
Der Name „Zebrastreifen“ war geboren, und farblich gesehen ist der ebenfalls nicht überall schwarz-weiß. Zum Beispiel ist er in der Schweiz gelb-weiß. Und auch wenn er praktisch nichts mit dem Tier Zebra tun hat, so werden sich die Initiatoren der Aktion von 1954 sicherlich ein Schmunzeln nicht ganz verkneifen haben können.
Ich schätze mal, das gleiche Schmunzeln dürfte auch Biggs et al (1952) begleitet haben, als sie ihre Entdeckung benannten. Immerhin waren Stephen Christmas‘ Auftreten und die Entdeckung des Christmas-Faktor zweifellos ein weihnachtliches Wunder, das der Hämostase-Forschung neues Licht schenkte.
Symbolbild: Ein Thrombus dichtet leckes Endothel ab und ruft die Gerinnungsfaktoren herbei. © 7
_____________________
Genderhinweis: Allein aus Gründen der Lesbarkeit wird auf die gleichzeitige Verwendung der Sprachformen männlich, weiblich und divers (m/w/d) verzichtet. Sämtliche Personenbezeichnungen gelten gleichermaßen für alle Geschlechter.
_____________________
Quellen (Text):
- Biggs, R., Douglas, A. S., Macfarlane, R. G., Dacie, J. V., Pitney, W. R., Merskey, C., & O’Brien, J. R. (1952). Christmas disease: a condition previously mistaken for haemophilia. British Medical Journal, 2, 1378-1382. PMID 12997790
- Deutsche Gesellschaft für Unfallchirurgie. (2023). Ältere Fußgänger werden im Straßenverkehr oft übersehen und bewegen sich zunehmend unsicher. https://www.dgu-online.de/aktuelles/news/detailansicht/aeltere-fussgaenger-werden-im-strassenverkehr-oft-uebersehen-und-bewegen-sich-zunehmend-unsicher-3830. (Zuletzt aufgerufen am 07.12.2024).
- DocCheck. (2024). Gerinnungsfaktoren. https://flexikon.doccheck.com/de/Gerinnungsfaktor. (Zuletzt aufgerufen am 07.12.2024).
- DocCheck. (2024). Hämophilie. https://flexikon.doccheck.com/de/H%C3%A4mophilie. (Zuletzt aufgerufen am 07.12.2024).
- Giangrande, P. (2005). Haemophilia B: christmas disease. Expert opinion on pharmacotherapy, 6(9), 1517-1524. https://doi.org/10.1517/14656566.6.9.1517
- Graham, J. B., & Brinkhous, K. M. (1953). Christmas disease. British Medical Journal, 2(4827), 97. 10.1136/bmj.2.4827.97-a
- Huppelsberg, J., & Walter, K. (2013). Kurzlehrbuch Physiologie. Stuttgart. Thieme.
- Kiv, R. (2023). Everything to Know About Hemophilia B. https://www.healthline.com/health/hemophilia-b#what-it-is. (Zuletzt aufgerufen am 07.12.2024).
- König, N., Wichert, S., & Baum, V. (2024). Warum hat das Zebra Streifen? https://www.br.de/kinder/zebra-warum-hat-das-zebra-streifen-kinder-lexikon-100.html. (Zuletzt aufgerufen am 07.12.2024).
- Kühne, T., Schifferli, A., & Kühne, T. (2016). Hämophilie. Kompendium Kinderhämatologie, 163-174. Springer.
- Löffelhardt, C. (2023). Gehen oder stehen: Was gilt am Zebrastreifen? https://www.zdf.de/nachrichten/panorama/zebrastreifen-bedeutung-strassenverkehr-ordnung-regeln-beatles-100.html. (Zuletzt aufgerufen am 07.12.2024).
- Pape, H.-P., Kurtz, A., Silbernagl, S. (2023). Physiologie. Stuttgart. Thieme.
- Streiff, M.B. (2023). Hämophilie. https://www.msdmanuals.com/de/profi/h%C3%A4matologie-und-onkologie/gerinnungsst%C3%B6rungen/h%C3%A4mophilie. (Zuletzt aufgerufen am 07.12.2024).
Quellen (Bilder):

Nicolas Bauder
Redakteur




